KLASIFIKASI SENYAWA ORGANIK
Penggolongan
hidrokarbon umumnya berdasarkan bentuk rantai karbon dan jenis ikatannya.
Berdasarkan
bentuk rantai karbonnya, hidrokarbon digolongkan kedalam dua golongan besar, yaitu
senyawa rantai terbuka (senyawa alifatik) dan senyawa rantai tertutup (senyawa
siklik).
1. Senyawa Rantai Terbuka (Senyawa Alifatik)
Senyawa hidrokarbon alifatik adalah senyawa karbon yang rantai C nya terbuka dan rantai C itu memungkinkan bercabang. Berdasarkan jumlah ikatannya, senyawa hidrokarbon alifatik terbagi menjadi senyawa alifatik jenuh dan tidak jenuh.
a. Alkana
Alkana termasuk senyawa alifatik jenuh. Berdasarkan
strukturnya alkana merupakan suatu hidrokarbon yang mempunyai ikatan tunggal
antara C dan C nya. Oleh karena semua C sudah mengikat 4 atom lain, maka alkana
disebut hidrokarbon jenuh atau parafin. Parafin artinya mempunyai daya gabung
yang kecil atau sukar bereaksi dengan zat lain. Ikatan unggal terjadi dari
orbital s dan disebut ikatan sigma pada orbital hibrid sp3 dan
bentuk molekul tetrahedron dengan sudut 109,50.
Dalam metana, masing-masing orbital sp3
dari karbon bertumpang tindih dengan orbital 1s dari hidrogen. Masing-masing
orbital molekul sebagai resultante sp3-s adalah simetrik sekeliling
sumbu yang lewat inti karbon dan hidrogen. Ikatan kovalen antara C dan H dalam
metana, seperti ikatan kovalen H-H, adalah ikatan sigma
Etana (CH3CH3) mengandung
dua atom karbon sp3. Kedua atom karbon ini membentuk ikatan sigma
C-C dengan tumpang tindih satu orbital sp3 dari masing-masing karbon
(ikatan sigma sp3-sp3). Masing-masing atom karbon
mempunyai tiga orbital atom sp3 sisa, dan masing-masing dari ini
tumpang tindih dengan orbital 1s dari atom hdrogen untuk membentuk ikatan sigma
C-H. Masing-masing atom karbon dalam etana adalah tetrahedral.
Bila senyawa alkana diurutkan berdasarkan jumlah
atom C nya, ternyata ada perbedaan jumlah atom C dan H secara teratur yaitu
CH2. Deret senyawa ini merupakanderet homolog yaitu suatu deret senyawa sejenis
yang perbedaan jumlah atom suatu senyawa dengan senyawa berikutnya sama. Dari
rumus-rumus molekul alkana di atas dapat disimpulkan bahwa rumus umum alkana
adalah:
CnH2n+2
n = jumlah atom karbon
Pada penulisan rumus senyawa karbon dikenal rumus molekul dan rumus struktur. Contoh penulisan rumus molekul dan rumus struktur alkana dapat dilihat pada Tabel berikut :
Kereaktifan alkana
Semua
hidrokarbon merupakan senyawa nonpolar sehingga tidak larut dalam air. Jika
suatu hidrokarbon bercampur dengan air, maka lapisan hidrokarbon selalu di atas
sebab massa jenisnya lebih kecil daripada 1. Pelarut yang baik untuk
hidrokarbon adalah pelarut nonpolar, seperti CCl4 atau
atau sedikit polar (dietil eter atau benzena).
Alkana
hampir tidak dapat larut dalam air, tapi larut dalam pelarut organik. Alkana
dalam bentuk cair merupakan pelarut yang baik untuk berbagai senyawa kovalen
yang lain.
Alkana mengandung ikatan tunggal C-C
yang kuat dan ikatan C-H yang juga kuat. Ikatan C-H memiliki polaritas yang
sangat rendah sehingga tidak ada molekulnya yang membawa jumlah ion positif
atau negatif yang signifikan untuk menarik molekul lainnya.
Olehnya itu alkana-alkana memiliki reaksi yang cukup terbatas.
Beberapa hal yang bisa dilakukan pada alkana:
Olehnya itu alkana-alkana memiliki reaksi yang cukup terbatas.
Beberapa hal yang bisa dilakukan pada alkana:
- alkana bisa dibakar, yakni memusnahkan seluruh molekulnya;
- alkana bisa direaksikan dengan beberapa halogen yakni memutus ikatan C-H;
- alkana bisa dipecah, yakni dengan memutus ikatan C-C.
Semakin
bertambah jumlah atom C maka Mr ikut bertambah akibatnya titik didih dan titik
leleh semakin tinggi. Alkana rantai lurus mempunyai titik didih lebih tinggi
dibanding alkana rantai bercabang dengan jumlah atom C sama. Semakin banyak
cabang, titik didih makin rendah.
Pada
suhu dan tekanan biasa, empat alkana yang pertama (CH4 sampai C4H10
berwujud gas. Pentana (C5H12)
sampai heptadekana (C17H36)
berwujud cair, sedangkan oktadekana (C18H38)
dan seterusnya berwujud padat.
Tabel Beberapa sifat fisik
alkana
Nama alkana
|
Rumus molekul
|
Mr
|
Titik leleh (ºC)
|
Titik didih (ºC)
|
Wujud pada 25ºC
|
Metana
|
CH4
|
16
|
-182
|
-162
|
gas
|
Etana
|
C2H6
|
30
|
-183
|
-89
|
gas
|
Propana
|
C3H8
|
44
|
-188
|
-42
|
gas
|
Butana
|
C4H10
|
58
|
-138
|
-0,5
|
gas
|
Pentana
|
C5H12
|
72
|
-130
|
36
|
cair
|
Heksana
|
C6H14
|
6
|
-95
|
69
|
cair
|
Heptana
|
C7H16
|
100
|
-91
|
99
|
cair
|
Oktana
|
C8H18
|
114
|
-57
|
126
|
cair
|
Nonana
|
C9H20
|
128
|
-54
|
151
|
cair
|
Dekana
|
C10H22
|
142
|
-30
|
174
|
cair
|
Undekana
|
C11H24
|
156
|
-26
|
196
|
cair
|
Dodekana
|
C12H26
|
170
|
-9,6
|
216
|
cair
|
Tridekana
|
C13H28
|
184
|
-5,4
|
235
|
cair
|
Tetradekana
|
C14H30
|
198
|
5,9
|
254
|
cair
|
Pentadekana
|
C15H32
|
212
|
9,9
|
271
|
cair
|
Heksadekana
|
C16H34
|
226
|
18
|
287
|
cair
|
Heptadekana
|
C17H36
|
240
|
22
|
302
|
cair
|
Oktadekana
|
C18H38
|
254
|
28
|
316
|
padat
|
Nonadekana
|
C19H40
|
268
|
32
|
330
|
padat
|
Eikosana
|
C20H42
|
282
|
37
|
343
|
padat
|
Pembakaran/oksidasi
alkana bersifat eksotermik (menghasilkan kalor). Pembakaran alkana berlangsung
sempurna dan tidak sempurna. Pembakaran sempurna menghasilkan gas CO2 sedang
pembakaran tidak sempurna menghasilkan gas CO. Itulah sebabnya alkana digunakan
sebagai bahan bakar. Secara rata-rata, oksidasi 1 gram alkana menghasilkan
energi sebesar 50.000 joule.
Reaksi
pembakaran sempurna :
CH4(g)
+ 2 O2(g) → CO2(g) + 2 H2O(g)
+ Energi
Reaksi
pembakaran tak sempurna:
2
CH4(g) + 3 O2(g) → 2 CO(g) + 4 H2O(g)
+ Energi
Jika
direaksikan dengan unsur-unsur halogen (F2, Cl2, Br2,
dan I2), maka atom-atom H pada alkana mudah mengalami
substitusi (penukaran) oleh atom-atom halogen.
CH4 +
Cl2 → CH3Cl (metilklorida (klorometana)) + HCl
CH3Cl
+ Cl2 → CH2Cl2 (diklorometana) + HCl
CH2Cl2 +
Cl2→ CHCl3 (kloroform (triklorometana)) + HCl
CHCl3 +
Cl2 → CCl4 (karbon tetraklorida) + HCl
Senyawa
alkana rantai panjang dapat mengalami reaksi eliminasi. Reaksi eliminasi adalah
reaksi penghilangan atom/gugus atom untuk memperoleh senyawa karbon lebih
sederhana. Contoh pada reaksi eliminasi termal minyak bumi dan gas alam.
800
- 900 oC
|
||||
CH3 -
CH2 - CH3
|
→
|
CH3 -
CH = CH2 + H2
|
||
propana
|
propena
|
|||
800
- 900 oC
|
||||
CH3 -
CH2 - CH3
|
→
|
CH2 =
CH2
|
+
|
CH4
|
propana
|
etena
|
metana
|
b. Alkena
Alkena merupakan salah satu senyawa hidrokarbon alifatik yang bersifat tidak jenuh, tetapi cukup bersifat reaktif. Istilah yang digunakan adalah tidak jenuh, yang menandakan bahwa alkena mengandung atom hidrogen yang kurang dari jumlah semestinya, jika dihubungkan dengan jumlah atom karbonnya. Alkena juga masih mempunyai daya ikat terhadap molekul lain akibat adanya ikatan rangkap di antara atom C-nya.
Gugus fungsi alkena yang utama adalah adanya ikatan rangkap dua antar karbon (C=C). Gugus fungsi ini sangat mempengaruhi reaksi pada golongan alkena. Secara umum, reaksi yang dapat terjadi pada alkena dapat dikategorikan menjadi dua jenis, yaitu reaksi pada ikatan rangkap dan reaksi di luar ikatan rangkap. Reaksi alkena yang terjadi pada ikatan rangkap dinamakan reaksi adisi, sedangkan di luar katan rangkap dinamakan reaksi substitusi.
Hidrokarbon alifatik tak jenuh dapat juga mengandung lebih dari satu ikatan rangkap, sebagai contoh adalah senyawa alkadiena. Alkadiena adalah hidrokarbon alifatik tak jenuh yang mengandung dua buah ikatan rangkap.
Alkena juga disebut olefin. Alkena memiliki ikatan pi antara atom karbon, dan ketika mengalami banyak sekali reaksi yang memecah ikatan pi dalam rangka untuk membentuk ikatan tunggal sehingga mereka lebih reaktif daripada alkana tetapi relatif stabil dibandingkan dengan alkuna.
Pasangan elektron yang menjadi milik
bersama terletak dalam sebuah orbital molekul pada garis antara dua inti.
Ikatan ini dinamakan ikatan sigma.
Pasangan
elektron yang lain ditemukan di suatu tempat dalam bagian berarsir di atas atau
di bawah bidang molekul. Ikatan ini
adalah ikatan pi. Elektron-elektron dalam ikatan pi bebas berpindah kemanapun
dalam daerah berarsir ini dan dapat berpindah bebas dari belahan yang satu ke
belahan yang lain.
Elektron pi tidak sepenuhnya dikendalikan oleh inti atom C seperti pada elektron dalam ikatan sigma, dan karena elektron pi terletak di atas dan di bawah daerah kosong dari molekul, maka elektron-elektron ini relatif terbuka untuk diserang oleh partikel lain. Apa artinya? Ikatan pi lebih lemah dibanding ikatan sigma. Ikatan pi mudah diadisi oleh atom-atom lain.Kereaktifan alkena ditentukan oleh lemahnya ikatan pi. Sifat kimia alkena yang merupakan ciri khas adalah reaksi adisi, sehingga hidrokarbon tak jenuh ini mudah diadisi dan menghasilkan hidrokarbon jenuh.
Elektron pi tidak sepenuhnya dikendalikan oleh inti atom C seperti pada elektron dalam ikatan sigma, dan karena elektron pi terletak di atas dan di bawah daerah kosong dari molekul, maka elektron-elektron ini relatif terbuka untuk diserang oleh partikel lain. Apa artinya? Ikatan pi lebih lemah dibanding ikatan sigma. Ikatan pi mudah diadisi oleh atom-atom lain.Kereaktifan alkena ditentukan oleh lemahnya ikatan pi. Sifat kimia alkena yang merupakan ciri khas adalah reaksi adisi, sehingga hidrokarbon tak jenuh ini mudah diadisi dan menghasilkan hidrokarbon jenuh.
Alkena yang paling sederhana adalah etena atau etilena
(C2H4). Dalam etilena (CH=CH), dua karbon sp2 dapat
digabung oleh ikatan sigma yang
terbentuk karena tumpang tindih satu orbital sp2 dari masing-masing
atom karbon. (Ikatan sigma ini adalah salah satu ikatan dari ikatan rangkap
rangkap dua). Setiap atom karbon masih mempunyai dua orbital sp2
tersisa untuk ikatan dengan hidrogen.
Bagaimana dengan sisa
orbital p pada setiap karbon ? Setiap orbital p mempunyai dua cuping, satu
diatas bidang ikatan sigma dan yang lain (dengan amplitudo yang berlawanan) di
bawah bidang. Setiap orbital p mengandung satu elektron. Bila elektron p
menjadi berpasangan dalam orbital molekul ikatan, maka energi sistem akan
turun. Karena orbital p berdampingan dalam molekul etilena, ujung orbital tak
dapat saling tumpang tindih, seperti halnya dalam pembentukan ikatan sigma. Kedua
orbital p ini kemudian tumpang tindihlewat sisinya. Hasil dari tumpang tindih
sisi terhadap sisi ini ialah ikatan pi suatu orbital molekul ikatanyang
menggabungkan dua karbon dan terlokasi di atas dan di bawah bidang dari ikatan
sigma. Ikatan pi adalah ikatan kedua dari ikatan rangkap dua
Alkena merupakan
hidrokarbon tidak jenuh dengan sebuah ikatan rangkap. Suatu alkena mengikuti
rumus umum CnH2n. Sebagai contoh adalah etena yang
mempunyai rumus molekul C2H4 dan propena yang mempunyai rumus
molekul C3H6. Inilah rumus struktur etena dan propena:
Berdasarkan teori
tolakan pasangan elektron valensi (Valence Shell Electron Pair Repulsion,
VSEPR), dapat diramalkan bahwa ikatan antar karbon membentuk sudut sekitar
120º, walaupun nyatanya tidak selalu tepat demikian. Pada gambar di atas, etena
mempunyai sudut ikatan sebesar 121,7º, sedangkan sudut ikatan pada propena
adalah 124,7º. Besarnya sudut ikatan ini dipengaruhi oleh besarnya gugus yang
terikat oleh atom karbon yang mempunyai ikatan rangkap. Sudut akan semakin
besar jika gugus yang diikat juga semakin besar.
Kereaktifan alkena
Pada suhu kamar, tiga suku yang pertama adalah gas, suku-suku berikutnya adalah
cair dan suku-suku tinggi berbentuk padat. Jika cairan alkena dicampur dengan
air maka kedua cairan itu akan membentuk lapisan yang saling tidak bercampur.
Karena kerpatan cairan alkena lebih kecil dari 1 maka cairan alkena berada di
atas lapisan air.
Alkena dapat
terbakar dengan nyala yang berjelaga karena kadar karbon alkena lebih tinggi
daripada alkana yang jumlah atom karbonnya sama.
Tabel 5. Beberapa sifat fisik alkena
Nama
alkena
|
Rumus
Molekul
|
Mr
|
Titik
leleh
|
Titik
didih
|
Kerapatan
|
Fase
pada
|
(oC)
|
(0C)
|
(g/Cm3)
|
250C
|
|||
Etena
|
C2H4
|
28
|
-169
|
-104
|
0,568
|
Gas
|
Propena
|
C3H6
|
42
|
-185
|
-48
|
0,614
|
Gas
|
1-Butena
|
C4H8
|
56
|
-185
|
-6
|
0,630
|
Gas
|
1-Pentena
|
C5H10
|
70
|
-165
|
30
|
0,643
|
Cair
|
1-Heksena
|
C6H12
|
84
|
-140
|
63
|
0,675
|
Cair
|
1-Heptena
|
C7H14
|
98
|
-120
|
94
|
0,698
|
Cair
|
1-Oktena
|
C8H16
|
112
|
-102
|
122
|
0,716
|
Cair
|
1-Nonesa
|
C9H18
|
126
|
-81
|
147
|
0,731
|
Cair
|
1-Dekena
|
C10H20
|
140
|
-66
|
171
|
0,743
|
Cair
|
Sifat
khas dari alkena adalah terdapatnya ikatan rangkap dua antara dua buah atom
karbon. Ikatan rangkap dua ini merupakan gugus fungsional dari alkena sehingga
menentukan adanya reaksi-reaksi yang khusus bagi alkena, yaitu adisi,
polimerisasi dan pembakaran.
Alkena
dapat mengalami adisi. Adisi adalah pengubahan ikatan rangkap (tak jenuh)
menjadi ikatan tunggal (jenuh) dengan cara menangkap atom/gugus lain. Pada
adisi alkena 2 atom/gugus atom ditambahkan pada ikatan rangkap C=C sehingga
diperoleh ikatan tunggal C-C. Beberapa contoh reaksi adisi pada alkena:
a.
Reaksi alkena dengan halogen (halogenisasi)
b.
Reaksi alkena dengan hidrogen halida (hidrohalogenasi)
Hasil reaksi antara
alkena dengan hidrogen halida dipengaruhi oleh struktur alkena, apakah alkena
simetris atau alkena asimetris.
alkena
simetris : akan menghasilkan satu haloalkana.
alkena
asimetris akan menghasilkan dua haloalkana. Produk utana reaksi dapat
diramalkan menggunakan aturan Markonikov, yaitu: Jika suatu
HX bereaksi dengan ikatan rangkap asimetris, maka produk utama reaksi adalah
molekul dengan atom H yang ditambahkan ke atom C dalam ikatan rangkap yang
terikat dengan lebih banyak atom H.
c. Reaksi alkena dengan hidrogen (hidrogenasi)
1.
Reaksi ini akan menghasilkan alkana.
Alkena
menambahkan hidrogen dengan adanya katalis platina atau nikel, untuk membentuk
alkana
CnH2n + H2 → CnH2n + 2 +panas
2.
Alkena dapat mengalami polimerisasi. Polimerisasi adalah penggabungan
molekul-molekul sejenis menjadi molekul-molekul raksasa sehingga rantai karbon
sangat panjang. Molekul yang bergabung disebut monomer, sedangkan molekul raksasa yang terbentuk disebut polimer.
3.
Pembakaran alkena (reaksi alkena dengan oksigen) akan menghasilkan CO2 dan H2O.
c. Alkuna
Alkuna juga hidrokarbon tak jenuh, mereka memiliki satu atau lebih ikatan rangkap tiga antara atom karbon. Rumus umum mereka adalah CnH2n-2, dalam hal apapun merupakan senyawa non-siklik. Mereka juga dikenal sebagai Asetilena. Alkuna lebih reaktif daripada alkena dan alkana, mereka banyak menampilkan sebagai polimerisasi dan oligomerisasi. Polimer yang dibentuk disebut Polyethylene yang menunjukkan sifat semikonduktor. Mereka sangat reaktif disebabkan oleh adanya, ikatan jenuh rangkap tiga dan mudah mengalami reaksi adisi.
Alkuna adalah suatu golongan hidrokarbon alifatik yang mempunyai gugus fungsi berupa ikatan ganda tiga karbon-karbon (-C≡C-). Seperti halnya ikatan rangkap dalam alkena, ikatan ganda tiga dalam alkuna juga disebut ikatan tidak jenuh. Ketidakjenuhan ikatan ganda tiga karbon-karbon lebih besar daripada ikatan rangkap. Oleh karena itu kemampuannya bereaksi dengan pereaksi-peraksi yang dapat bereaksi dengan alkena juga lebih besar. Hal inilah yang menyebabkan golongan alkuna memiliki peranan khusus dalam sintesis senyawa organik.
Dalam CH≡CH, kedua atom
karbon dihubungkan oleh ikatan sigma sp-sp. Masing-masing karbon juga terikat
terhadap atom hidrogen oleh ikatan sigma sp-s.
Kedua orbital p dari satu karbon kemudian bertumpang tindih dengan kedua
orbital p dari karbon lain untuk membentuk dua ikatan pi, satu ikatan pi ada
diatas dan dibawah ikatan sigma.
Seperti dapat
diramalkan, reaksi kimia suatu senyawa yang mengandung ikatan ganda tiga tidak
terlalu berbeda dari senyawa yang mengandung ikatan rangkap. Sebagai ganti satu
ikatan pi, disini ada dua.
Alkuna merupakan
golongan hidrokarbon yang memiliki ikatan ganda tiga (istilah "ganda
tiga" digunakan untuk membedakan "rangkap dua" milik alkena).
Dengan demikian alkuna juga termasuk hidrokarbon tidak jenuh. Senyawa alkuna
yang paling kecil adalah etuna (C2H2) dengan rumus
struktur HC≡CH. Dengan demikian, dapat dipahami bahwa bentuk tiga dimensi dari
etuna adalah linier, dengan sudut ikatan sebesar 180º dengan panjang ikatan
sebesar 0,121 nm.
Reaksi- reaksi pada alkuna
mirip dengan alkena, hanya berbeda pada kebutuhan jumlah pereaksi untuk
penjenuhan ikatan rangkap. Alkuna membutuhkan jumlah
pereaksi dua kali kebutuhan pereaksi pada alkena untuk jumlah ikatan rangkap
yang sama.
Alkuna juga sama seperti alkana dan alkena, tidak dapat larut dalam air.
Titik didih alkuna mirip dengan alkana dan alkena. Semakin bertambah jumlah atom C harga Mr makin besar maka titik didihnya makin tinggi.
Alkuna juga sama seperti alkana dan alkena, tidak dapat larut dalam air.
Titik didih alkuna mirip dengan alkana dan alkena. Semakin bertambah jumlah atom C harga Mr makin besar maka titik didihnya makin tinggi.
2. Senyawa Rantai Tertutup (Senyawa Siklik)
Senyawa hidrokarbon siklik adalah senyawa karbon yang rantai C nya melingkar dan lingkaran itu mungkin juga mengikat rantai samping. Terdiri dari dua jenis:
a. Senyawa Homosiklik
Senyawa homosiklik adalah senyawa-senyawa dimana cincin hanya terdiri dari atom karbon. Senyawa homosiklik atau karbosiklik dibagi lagi menjadi senyawa alisiklik dan senyawa aromatik.
Senyawa alisiklik
Suatu senyawa
alisiklik adalah suatu senyawa
organik berupa alifatik
sekaligus siklik. Senyawa ini mengandung satu atau lebih
cincin karbon, baik jenuh maupun tak
jenuh, tetapi tidak memiliki karakter aromatik.
Senyawa alisiklik dapat memiliki satu atau lebih rantai cabang
alifatik. Contoh senyawa alisiklik adalah siklopropana, siklobutana, dan sikloheksana.
Senyawa aromatik
Senyawa
aromatik adalah senyawa hidrokarbon dengan ikatan tunggal dan ikatan rangkap
diantara atom-atom karbonnya. Kongfigurasi 6 atom karbon pada senyawa ini di
kenal dengan cincin benzene.
Hal ini biasanya dianggap terjadi karena elektron-elektron bisa berputar di dalam bentuk susunan lingkaran atom-atom, yang bergantian antara ikatan kovalen tunggal dan ganda. Ikatan-ikatan ini bisa dipandang sebagai ikatan hibrida (campuran) antara ikatan tunggal dan ikatan ganda, setiap ikatan-ikatan ini adalah sama (identis) dengan ikatan yang lainnya. Model cincin aromatis yang umum dipakai, yaitu sebuah cincin benzena (cyclohexatriena) adalah terbentuk dari cincin beranggota enam karbon yang bergantian, pertama kali dikembangkan oleh Kekulé.
Benzena
Model benzena ini terdiri dari dua bentuk resonansi, yang menggambarkan ikatan covalen tunggal dan ganda yang bergantian posisi. Benzena adalah sebuah molekul yang lebih stabil dibandingkan yang diduga tanpa memperhitungkan delokalisasi muatan.
Ikatan
rangkap pada benzena berbeda dengan ikatan rangkap pada alkena. Ikatan
rangkap pada alkena dapat mengalami reaksi adisi, sedangkan ikatan rangkap pada
benzena tidak dapat diadisi, tetapi benzena dapat bereaksi secara substitusi.
Contoh:
Reaksi
adisi
: C2H4 + Cl2 --> C2H4Cl2
Reaksi
substitusi : C6H6
+ Cl2 --> C6H5Cl + HCl
Menurut
Friedrich August Kekule, keenam atom karbon pada benzena tersusun secara siklik
membentuk segienam beraturan dengan sudut ikatan masing-masing 120°. Ikatan
antaratom karbon adalah ikatan rangkap dua dan tunggal bergantian
(terkonjugasi).
Analisis
sinar-X terhadap struktur benzena menunjukkan bahwa panjang ikatan antaratom
karbon dalam benzena sama, yaitu 0,139 nm. Adapun panjang ikatan rangkap dua
C=C adalah 0,134 nm dan panjang ikatan tunggal C–C adalah 0,154 nm. Jadi,
ikatan karbon-karbon pada molekul benzena berada di antara ikatan rangkap dua
dan ikatan tunggal. Hal ini menggugurkan struktur dari Kekule..
Fenil
Dalam kimia, gugus fenil atau cincin fenil (atau sering disingkat -Ph) adalah salah satu gugus
fungsional pada suatu rumus kimia C6H5
Pada gugus ini, enam atom
karbon disusun pada struktur cincin siklik. Cincin ini bersifat sangat stabil,
dan merupakan bagian dari kelompok senyawa aromatik. Cincin fenil bersifat hidrofobik (menolak air)
dan hidrokarbon
aromatik. Gugus ini dapat ditemukan di banyak senyawa organik. Cincin ini
diperkirakan diturunkan dari benzena, (C6H6). Di beberapa literatur kimia, benzena sendiri
sering disingkat Ph. Senyawa
bergugus fenil paling sederhana adalah fenol, C6H5OH.
Gugus Fenil
b. Senyawa Heterosiklik
Senyawa heterosiklik adalah ketika lebih dari satu jenis atom berada dalam satu senyawa cincin. Dalam senyawa ini umumnya satu atau lebih atom unsur seperti nitrogen 'N', oksigen 'O', atau sulfur 'S' ada didalam cincin. atom selain karbon yaitu N, O, atau S yang ada dalam cincin disebut heteroatom. Senyawa heterosiklik dengan lima dan enam atom disebut heterosiklik beranggota lima dan enam.
Cincin aromatik yang mengandung atom
nitrogen dapat dibedakan menjadi cincin aromatik basa dan cincin aromatik
non-basa.
- Pada cincin aromatik basa, pasangan menyendiri elektron bukanlah bagian dari sistem aromatik cincin tersebut. Pasangan menyendiri ini bertanggungjawab terhadap kebasaan basa ini. Dalam senyawa-senyawa ini, atom nitrogen tidak berikatan dengan atom hidrogen. Contoh cincin aromatik basa adalah piridina dan kuinolina. Beberapa cincin bisa saja mengandung atom nitrogen basa dan non-basa secara bersamaan, misalnya imidazola dan purina..
- Pada cincin non basa, pasangan menyendiri elektron atom nitrogen berdelokalisasi dan berkontribusi terhadap sistem aromatik elektron pi. Dalam senyawa ini, atom nitrigen berikatan dengan atom hidrogen. Contoh cincin aromatik non-basa ini adalah pirola dan indola.
Pada cincin aromatik yang mengandung
atom oksigen dan sulfur, satu dari dua pasangan elektron heteroatom tersebut
berkontribusi terhadap sistem aromatik senyawa.
Pirola
Tiofena











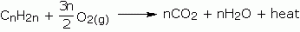









assalamualaikum,saya ingin bertanya tolong jelaskan perbedaan rantai tertutup yang ikatan jenuh dan tidak jenuh tersebut beserta contohnya?
BalasHapusSaya akan mencoba menjawab pertanyaan anda. Kalau rantai yang ikatan tidak jenuh adalah dalam senyawa rantai tertutup yang terdapat ikatan rangkap dua. Contoh dari senyawa ini adalah siklobutena atau sikloheksena. Sedangkan senyawa rantai tertup yang ikatan jenuh adalah senyawa rantai tertutup yang tidak memiliki ikatan rangkap. Contoh dari senyawa ini adalah siklobutana dan sikloheksana.
HapusAssalamualaikum, selamat pagi :)
BalasHapuspostingan dalam blog anda menarik , terutama pada materi senyawa aromatik, dimana dikatan bahwa Dalam kimia, gugus fenil atau cincin fenil (atau sering disingkat -Ph) adalah salah satu gugus fungsional pada suatu rumus kimia C6H5 Pada gugus ini, enam atom karbon disusun pada struktur cincin siklik. Cincin ini bersifat sangat stabil, dan merupakan bagian dari kelompok senyawa aromatik. Nah yang ingin saya tanyakan , apa yang menyebabkan salah atu contoh dari senyawa aromatik yakni fenil bisa dikatan sangat stabil ?
terimakasih :)
Saya akan mencoba menjawab pertanyaan anda. Fenil merupakan suatu benzena yang kehilangan satu atom H nya. kestabilan cincin ini disebabkan karena enam atom karbonnya disusun pada stuktur cincin siklik. Cincin ini diperkirakan diturunkan dari benzena, (C6H6). Di beberapa literatur kimia, benzena sendiri sering disingkat Ph. Senyawa bergugus fenil paling sederhana adalah fenol, C6H5OH.
Hapusselamat pagi sheira semoga harimu menyenangkan , postingan yang bermanfaat bagi pembaca , setelah membaca blog saudari saya ingin bertanya pada kalimat " Pada cincin non basa, pasangan menyendiri elektron atom nitrogen berdelokalisasi dan berkontribusi terhadap sistem aromatik elektron pi , kenapa bisa begitu sheira bisakah saudari berikan penjelasannya ?, terima kasih sebelumnya.
BalasHapusSaaya akan mencoba menjawab pertanyaan saudara Robi. , pasangan menyendiri elektron merupakan bagian dari sistem aromatik cincin tersebut, sehingga pasangan menyendiri elektron atom nitrogen berdelokalisasi dan berkontribusi terhadap sistem aromatik elektron pi. Dalam senyawa-senyawa ini, atom nitrogen berikatan dengan atom hidrogen.
Hapusassalamu'alaikum wr.wb saya frandi mardiansyah. disini saya akan mencoba menjawab pertanyaan dari saudari nita. bahwa perbedaan ikatan jenuh dan tidak jenuh pada senyawa tertutup itu sama dengan perbedaan ikatan jenuh dan tidak jenuh pada senyawa terbuka. bahwa kalau ikatan jenuh itu adalah ikatan tunggal yang terjadi pada senyawa hidrokarbon dan senyawa tidak jenuh itu adalah ikatan rangkap 2 dan 3 yang terjadi pada senyawa hidrokarbon.
BalasHapusterimakasih atas penambahan jawabannya saudara Frandi.
Hapusassalamualaikum, saya ingin bertanya coba anda berikan gambar pada cincin aromatik basa dari piridina dan kuinolina?
BalasHapusterimakasih saudara novani, berhubung tidak dapat menambahkan gambar pada komentar ini, anda dapat melihat pada laman berikut ini : http://1.bp.blogspot.com/--rYkRPCvKWY/UUHnI4ImiDI/AAAAAAAAAAY/jp3J2yjm1qY/s1600/macam+alkaloid.jpg
Hapus